ساختار رزونانسی در مولکولهایی به کار میرود که ساختار لوییس پیشنهاد شده برای آنها، نشاندهنده خواص کامل و واقعی مولکول نباشد. این خواص میتوانند مواردی از قبیل طول و زاویه پیوند و یا همان دوقطبی باشند. در این حالت از چند ساختار لوییس بهجای یک ساختار استفاده میکنند. این ساختارها فقط در نحوه توزیع الکترونها متفاوت هستند و در مجموع خواص کامل و واقعی مولکول موردنظر را نشان میدهند. ذکر این نکته لازم است که ساختار حقیقی مولکول توسط هیبرید رزونانسی که میانگینی از ساختارهای رزونانسی است نشان داده میشود.
در نمایش الکترونهای غیر مستقر ساختارهای لوییس ضعیف عمل میکنند در نتیجه برای نمایش آنها از پدیده رزونانس استفاده میشود. الکترونهای پیوندی بهجای اینکه فقط بین دو اتم مستقر باشند، میتوانند بین بیش از دو اتم به اشتراک گذاشته شوند. بر همین اساس جاذبه بیش از دو هسته را احساس میکنند که به آنها الکترونهای پیوندی غیر مستقر گفته میشود. همچنین از طرفی الکترونهای نا پیوندی میتوانند بهصورت همزمان بین دو یا چند اتم قرار بگیرند. در این شرایط تنها تحتتأثیر یک هسته قرار ندارند و دیگر مستقر نیستند.
ساختار رزونانسی چیست
در حقیقت ساختار رزونانسی ساختاری است که بر اساس جابهجایی الکترون رابطه بین چند ساختار لوییس پیشنهادی را با ساختار واقعی مولکول توجیه میکند. توجه نمایید که ساختارهای رزونانسی را نباید بهصورت مخلوطی از هم در نظر داشت. تمام این ساختارهای لوییس پیشنهادی در واقع ساختار الکترونی مولکول را توصیف میکنند؛ ولی هیچ یک بهتنهایی واقعی و کامل نیستند. همانطور که گفته شد ساختار الکترونی واقعی مولکول را فقط هیبرید رزونانسی میتواند نشان دهد.
موقعی رزونانس رخ میدهد که یک پیوند پای در مجاورت پیوندهای سیگمای کاملاً مشابه قرار بگیرد. در واقع رزونانس حالتی است که در آن الکترونهای پیوند دوگانه در مولکول مستقر نیستند. بهعنوانمثال رزونانس در مولکول O3 را میتوان در نظر گرفت که دارای یک پیوند دوگانه و یک پیوند یگانه است. همانطور که میدانید طول پیوند دوگانه مولکول اوزون کمتر از طول پیوند یگانه است، بر همین اساس باتوجهبه رابطه بین طول پیوند و انرژی پیوند، میبایست انرژی پیوند دوگانه بیشتر از یگانه باشد.
سنجش انرژی و طول پیوندها در مولکول اوزون نشاندهنده این است که هر دو پیوند اکسیژن – اکسیژن از نظر طول و انرژی پیوند با هم یکسان هستند و در واقع حد واسط میان پیوند یگانه و دوگانه میباشد. در حقیقت در مولکول اوزون کاملاً هر دو پیوند اکسیژن – اکسیژن هم ارز هستند و از نظر خواص مابین پیوندهای دوگانه و یگانه میباشند. ساختار لوییس هم ارز در مولکول اوزون با نام ساختار رزونانس شناخته میشود. در تصویر زیر ساختار لوییس مولکول اوزون نشاندادهشده است.
به زبان سادهتر، بعضی مواقع الکترونهای اعم از پیوندی و غیرپیوندی، ویژگی غیر مستقر بودن از خود نشان میدهند. امکان دارد الکترونهای پیوندی بهجای اینکه بین دو اتم مستقر باشند بین بیش از دو اتم قرار بگیرند. چنین الکترونهایی که بین بیش از دو اتم هستند و جاذبه بیشتر از دو هسته را دریافت میکنند، الکترونهای پیوندی غیر مستقر مینامند. همچنین ممکن است الکترونهای غیرپیوندی بهجای اینکه بر روی یک اتم مستقر باشند بهصورت همزمان بر روی دو یا چند اتم قرار گرفته و حالت غیر مستقر پیدا کنند.
در نمایش الکترونهای غیر مستقر ساختارهای لوییس ضعیف هستند و جهتنمایش آنها به ساختار رزونانسی متصل میشوند. هر شکل رزونانسی الکترونهای غیر مستقر را در یکی از حالتهای امکانپذیر بهصورت مستقر نمایش میدهد. بین شکلهای رزونانسی با فلش دوطرفه رزونانس را نمایش میدهند و ساختار مولکول واقعی را از هیبرید رزونانسی یا ترکیب رزونانسی شکلهای رزونانسی به دست میآورند. به عبارتی از میانگینگیری شکلهای رزونانسی، ساختار مولکول واقعی حاصل میشود.
 نحوه خرید مواد شیمیایی و لوازم آزمایشگاهی
نحوه خرید مواد شیمیایی و لوازم آزمایشگاهی
امروزه به دلیل افزایش اجناس تقلبی در بازار، تشخیص و تهیه مواد شیمیایی و لوازم آزمایشگاهی اصل و باکیفیت امری دشوار است. در نتیجه برای تهیه این محصولات نیاز به یک تأمینکننده معتبر و باسابقه است. مجموعه تارا طب با بیش از ده سال سابقه فعالیت در زمینه و واردات و تأمین مواد شیمیایی و لوازم و تجهیزات آزمایشگاهی توانسته رضایت مشتریان خود را باکیفیت بالای محصول، قیمت مناسب و ارسال سریع جلب کند. شما میتوانید از طریق راههای ارتباطی موجود در سایت شرکت تارا مدرن طب تجهیز با مشاورین فروش ما جهت استعلام موجودی، قیمت و خرید در ارتباط باشید.
انواع رزونانس
رزونانس انواع و اقسام مختلفی دارد که بهصورت کلی میتوان به انواع مکانیکی، صوتی، الکترومغناطیسی، موج کوانتومی، مغناطیسی هستهای و چرخش الکترونی اشاره کرد.
رسم ساختار رزونانسی
محل اتمها در موقع رسم ساختارهای رزونانسی برابر است؛ ولی محل الکترونها فرق دارد. در حقیقت هر شکل رزونانسی میتواند الکترونهای غیر مستقر را در یکی از حالتهای ممکن به طور مستقر نشان دهد. جهت ارتباطدادن ساختارهای رزونانس فلشهای دوطرفه به کار میرود. در واقع این فلشها نشان میدهند که ساختار الکترونی کامل و واقعی در این گونه مولکولها میانگینی از این دو ساختار است. ذکر این نکته لازم است که مولکول اوزون بین این دو حالت نوسان نمیکند. ساختار رزونانس مولکول اوزون را در تصویر زیر مشاهده میکنید.
 سهم هر ساختار رزونانسی
سهم هر ساختار رزونانسی
از پایداری هر شکل رزونانسی جهت تعیین سهم هر شکل آن استفاده میشود. در واقع هر چه یکشکل رزونانسی پایدارتر، شکل آن مطلوبتر است. سهم آن شکل رزونانسی در این حالت در تعیین خواص واقعی مولکول بیشتر میشود. در نتیجه ساختار کامل و واقعی آن مولکول به شکل رزونانسی نزدیکتر است. اگر شکلهای رزونانسی یکسان و مشابه باشند سهم آنها نیز برابر خواهد بود؛ بنابراین میانگینگیری خواص مولکول واقعی را نشان میدهد. بهعنوانمثال برای مولکول اوزون که دو شکل رزونانسی مشابه است. سهم هر شکل رزونانسی 50 درصد میباشد. اگر مولکول SO3 را در نظر بگیرید باتوجهبه شکل زیر معلوم میشود که سهم هر شکل رزونانسی برابر با 3/33 درصد خواهد بود.
 قواعدی برای مقایسه پایداری شکلهای رزونانسی غیر همسان
قواعدی برای مقایسه پایداری شکلهای رزونانسی غیر همسان
- هر چقدر تعداد پیوندهای یک رزونانس بیشتر باشد، پایدارتر است.
- چنانچه تمام اتمها از قاعده اکتت پیروی کنند موجب پایداری آن شکل رزونانسی خواهند شد.
- الکترونگاتیویته باید با توزیع بارهای قراردادی روی اتمها همخوانی داشته باشد.
- نباید بارهای قراردادی همنام روی اتمهای مجاور قرار بگیرند.
- هر چقدر اندازه و تعداد بارهای کمتر باشد ساختار رزونانسی آن مطلوبتر میشود.
برای مثال در مولکول OCN– شکل رزونانسی سوم سمت راستی، به دلیل قرارگیری بار قراردادی مثبت روی اتم الکترونگاتیو اکسیژن و جدایی زیاد بار ناپایدار است؛ بنابراین حذف میشود.
 هیبرید رزونانسی چیست
هیبرید رزونانسی چیست
لازم به ذکر است که درنظرداشتن دو ساختار رسم شده در تصویر بالا به این معنا نیست که نیمی از مولکولهای اوزون ساختار سمت راستی و نیمی دیگر ساختار سمت چپی دارند، یا اینکه مولکول اوزون لحظاتی ساختار سمت چپی و لحظهای ساختار سمت راشتی را نشان میدهد. در واقع در کلیه لحظات، تمام مولکولهای اوزون یکشکل هستند و آن شکل نه ساختار سمت چپ و نه ساختار سمت راستی است. بلکه ساختار واقعی، ساختاری میانگین این دو ساختار است. ساختارهای رزونانسی در واقع فرضی هستند و ساختار واقعی ساختار هیبرید رزونانسی میباشد.
رسم ساختار هیبرید رزونانسی
برای رسم این ساختار، ابتدا ساختارهای رزونانس و لوییس را برای مولکول موردنظر رسم میکنند. سپس خطچین جهت نشاندادن پیوندهای دوگانه یا سهگانه مورداستفاده قرار میگیرد. در آخر فقط جفت الکترونهایی که در تمامی ساختارهای رزونانسی مشترکاند را رسم میکنند و مابقی جفت الکترونها را نشان نمیدهند. بهعنوان نمونه ساختار هیبرید رزونانس مولکول اوزون در تصویر زیر نشاندادهشده است.
 میزان پایداری هیبرید رزونانسی
میزان پایداری هیبرید رزونانسی
همان گونه که ذکر شد الکترونهای آزاد جاذبه تعداد هستههای بیشتری را حس میکنند در نتیجه الکترونهای مستقر پایدارتر هستند. وجود الکترونهای آزاد یا وجود رزونانس موجب افزایش انرژی پیوندها و در نتیجه پایداری مولکول میشود. هر مولکولی که بهصورت رزونانس نشان داده شود پایدارتر از سایر ساختارها است. بهعلاوه هر چه تعداد شکلهای رزونانسی بیشتر پایداری آنها به هم نزدیکتر باشد، پایداری بهدستآمده از رزونانس نیز بالاتر خواهد بود. این پایداری را پایداری رزونانسی مینامند.
لیستی از مولکولهای مختلف با داشتن ساختار رزونانسی
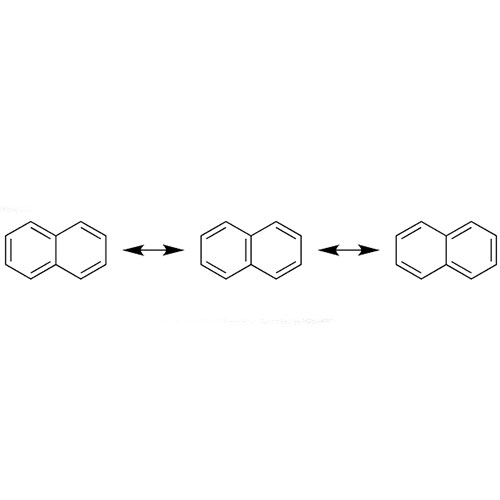
در یونها و مولکولهای زیاد و مختلفی، هیبرید رزونانس قابلمشاهده است. بهعنوانمثال میتوان به مولکولهایی از قبیل فسفات، کربوکسیلات، سولفیت، سولفات، بنزن،NO2 ، SO3، SO2 و یا یونهای کربنات و… اشاره کرد. ساختار رزونانسی و هیبرید رزونانس مولکول بنزن در تصویر زیر نشاندادهشده است.
 پدیده رزونانس در طبیعت و زندگی روزمره
پدیده رزونانس در طبیعت و زندگی روزمره
در طبیعت در موقعیتهای مختلفی رزونانس یا تشدید اتفاق میافتد. هر سیستم مکانیکی تمایل دارد در برخی از فرکانسها، با بیشترین دامنه ممکن نوسان ایجاد کند. به این وضعیت رزونانس و به این فرکانسها نیز فرکانس رزونانس میگویند. بهصورت کلی فرکانس تشدید همان فرکانس طبیعی سیستم میباشد. به طرز عجیبی رفتار سیستم در فرکانس رزونانس با رفتار آن در برابر سایر فرکانسها متفاوت است. با وقوع پدیده رزونانس، ارتعاش ضعیف در یک جسم میتواند باعث ارتعاش قوی در جسم دیگر شود.
همیشه پدیده رزونانس اتفاق بدی بهحساب نمیآید. مثلاً کودکی را در نظر بگیرید که سوار تاب است و کسی هم او را هل نمیدهد، او شروع به تابدادن خودش میکند. اگر این کار را با فرکانس درستی انجام دهد بعد از مدتی تاب با دامنه زیاد در حال جلو و عقب رفتن خواهد بود. به این نکته توجه کنید که نیرویی که کودک مصرف میکند کم است؛ ولی نتیجه آن دامنههای بزرگی را تشکیل میدهد. این تاب تمایل دارد بیشتر از انرژی وارد شده حرکت کند و به همین دلیل مقداری از انرژی که ذرهذره دریافت کرده را در خود نگه میدارد، در نهایت به دلیل همین انباشت انرژی داخل تاب بعد از یک مدتی شما با یک انگشت میتوانید تاب را حرکت دهید.
برای مثالی دیگر در این زمینه میتوان پیچ تنظیم رادیو را در نظر گرفت. در واقع با چرخاندن پیچ تنظیم در حال تغییر فرکانس طبیعی مدار الکتریکی رادیو هستیم. زمانی که این فرکانس طبیعی با فرکانس ایستگاه رادیویی موردنظر برابر شود جذب انرژی به مقدار بیشینه خواهد رسید و فقط صدای همان ایستگاه رادیویی را خواهیم شنید. در طرف مقابل رزونانس آثار مخربی نیز دارد.
در مورد شکستن شیشه نیز همینطور است. هنگامی که شیشه ارتعاش دریافتی از انفجار را دریافت میکند و آن را دفع نکرده و داخل خود نگه میدارد و نمیتواند تحملش کند، انرژی انباشته شده ناشی از ارتعاش را میشکند. به این نکته توجه داشته باشید که قرار نیست لزوماً یک ارتعاش بلند و لحظهای شیشه را بشکند، ممکن است ساعتها یا هفتهها طول بکشد تا یک لرزش ریز باعث شکستن شیشه شود.
میل به انباشت انرژی در اجسام وجود دارد که این هم مفید است و هم مضر. موقعی که زلزله اتفاق میافتد برخی از ساختمانها فرومیریزند، درحالیکه برخی دیگر پابرجا میمانند. یکی از عوامل تعیینکننده این فروپاشی، فرکانس طبیعی ساختمان یا فرکانس رزونانس است. در صورتی که فرکانس ارتعاش زمین با فرکانس طبیعی ساختمان یکی شود، ساختمان بیشترین دامنه نوسان و شدیدترین خسارت را تجربه میکند. پل تاکوما ناروز در سال 1940 در معرض بادی با سرعت 64 کیلومتر در ساعت قرار گرفت. یکی بودن فرکانس طبیعی پل با فرکانس باد باعث افزایش دامنه نوسان پل و تخریب آن شد.