تقطیر فرایندی شامل تبدیل مایع به بخار است که بعد از آن مجدد به شکل مایع متراکم میشود. سادهترین تعریف این فرایند بهصورت عملی بخار کتری است که بهصورت قطرههای آب بر روی یک سطح سرد رسوب میکند.
تقطیر چیست
تقطیر روشی برای جداسازی مواد شیمیایی است که بر پایه تفاوت در فراریت آنها انجام میشود. عموماً این روش بخشی از فرایند شیمیایی در واحدهای صنعتی است. این فرایند در دسته عملیات واحد قرار میگیرد. از تقطیر برای جداکردن مایع از جامد غیرفرار مانند جداسازی مشروبات الکلی از مواد تخمیر شده و جداسازی دو یا چند مایع با نقاط جوش متفاوت استفاده میشود. از دیگر کاربردهای آن جداسازی، نفت سفید، بنزین و روغن روانکاری از تقطیر نفت خام است. سایر کاربردهای صنعتی آن نیز شامل پردازش محصولات شیمیایی مانند فنل، نمکزدایی آب و فرمالدهید است. این فرایند میتواند بهصورت پیوسته یا ناپیوسته انجام شود که این مسئله به ساختار دستگاه آن بستگی دارد.
در حال حاضر تقطیر بهعنوان فرایندی مهم در صنعت، شیمی و علوم غذایی استفاده میشود. به این نکته توجه داشته باشید که تقطیر یک واکنش شیمیایی نیست؛ اما بهعنوان یک فرایند جداسازی فیزیکی میتواند در نظر گرفته شود. از این فرایند برای رسیدن به اهداف متنوعی استفاده میشود. همچنین هوا میتواند طی این روش به بخشهای مجزایی از قبیل هلیوم و اکسیژن تقریباً خالص تبدیل شود. یکی از کاربردهای هلیوم در بادکنکهای شادی و اکسیژن نیز در فرایندهای پزشکی است. تقطیر نفت خام منجر به تولید محصولات مناسبی جهت حملونقل، گرمایش و تولید برق میشود. بهمنظور بالابردن درصد خلوص الکل برای کاربردهای پزشکی نیز تقطیر به کار میرود.
فراریت تمایل یک ماده برای تبدیلشدن به فاز بخار است که رابطه مستقیمی با فشار بخار ماده دارد. هر چقدر فشار بخار ماده در دمای مشخص بالاتر باشد تمایل آن برای تبدیلشدن به بخار و در نتیجه فراریت آن بالاتر است. فراریت رابطه معکوسی با دمای جوش دارد؛ یعنی هر چقدر ماده فرارتر باشد، در دمای پایینتری به جوش میآید، بهعنوانمثال بنزین از آب فرارتر است.
مواد اولیه شیمیایی و لوازم آزمایشگاهی را از کجا میتوان تهیه کرد
شما برای تهیه مواد شیمیایی و لوازم آزمایشگاهی نیاز به یک تأمینکننده معتبر دارید. مجموعه تارا طب با بیش از ده سال سابقه فعالیت در زمینه واردات و تأمین مواد اولیه شیمیایی و لوازم و تجهیزات آزمایشگاهی توانسته رضایت مشتریان خود را باکیفیت بالای محصولات، قیمت مناسب و ارسال سریع جلب کند. شما میتوانید از طریق راههای ارتباطی موجود در سایت با مشاورین فروش ما بهصورت مستقیم در ارتباط باشید.
تاریخچه تقطیر
تقطیر به روش امروزی 800 سال پس از میلاد توسط دانشمند مسلمان جابربنحیان با اختراع انبیق انجام شد. البته این دانشمند اختراعات مختلفی در زمینه شیمی دارد همچنان استفاده میشود. بهعنوانمثال استفاده از بالن آزمایشگاهی با تجهیزات دیگر برای تقطیر نوع تکاملیافته انبیق است. پس از دوره کیمیاگری و شروع علم شیمی، قرع برای تقطیر مورد استفاده قرار گرفت. انبیق و قرع هر دو ظروفی شیشهای با گردن دراز و متمایل به یک سو هستند که بهعنوان چگالنده برای میعان مقطر استفاده میشوند. در هر دو ظرف انتهای خروجی جهت جمعآوری مقطر روبهپایین است.
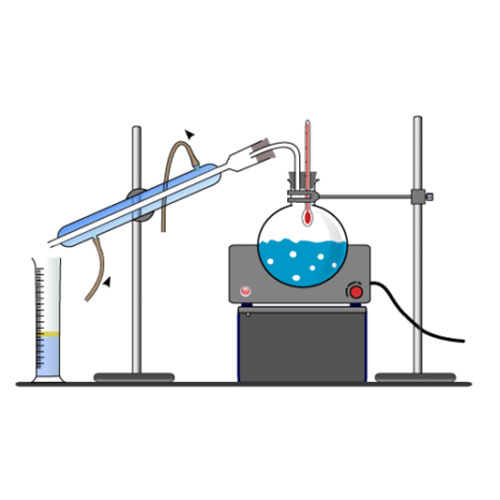
 تقطیر ساده چیست
تقطیر ساده چیست
اکثر روشهایی که در تحقیقات آزمایشگاهی و صنعت به کار میرود، تقطیر ساده است. این عملیات نیازمند استفاده از سیستم تقطیر برای گرمکردن مایع، یک کندانسور برای خنک نمودن بخار و یک گیره برای جمعآوری مایع بهدستآمده دارد. طی گرمکردن مخلوطی از مواد ابتدا فرارترین ماده که پایینترین نقطهجوش را دارد تقطیر میشود و مابقی متعاقباً یا اصلاً تقطیر نمیشوند. این دستگاه ساده جهت تصفیه مایعات حاوی مواد غیرفرار کاملاً راضیکننده است و برای جداسازی مایعات از نقاط جوش مختلف بسیار مناسب است. این دستگاه برای کاربرد آزمایشگاهی اغلب از شیشه ساخته میشود و با چوبپنبه، اتصالات شیشه یا دستههای لاستیکی متصل میشود. جهت کاربردهای صنعتی تجهیزات بزرگتری از سرامیک یا فلز و حتی برج تقطیر به کار میرود.
با انواع روشهای تقطیر آشنا شوید
تقطیر جز به جز
این روش که با نام تقطیر افتراقی یا فرکشنال شناخته میشود جهت کاربردهای خاص مانند تصفیه نفت به وجود آمده است؛ زیرا روش ساده این فرایند برای جداسازی مایعاتی که نقطهجوش نزدیک به یکدیگر دارند مناسب نیست. طی این عملیات بخارات حاصل بارها در یک ستون عمودی عایق شده متراکم و بخار میشوند تا اجزای مخلوط از یکدیگر جدا شوند.
تقطیر با بخار آب
اغلب از تقطیر بخار آب جهت جداسازی اجزای حساس به گرما در مخلوط مورداستفاده قرار میگیرد. این فرایند با عبور بخار از مخلوط صورت میگیرد تا مقداری از آن بخار شود. بدون نیاز به دمای بالا این روش سرعت انتقال حرارت بالا را ایجاد میکند. بخار بهدستآمده متراکم شده تا بتواند ماده موردنیاز را تأمین کند. این روش برای بهدستآوردن روغنهای اساسی و مقطرهای گیاهی از چندین گل و گیاهان معطر به کار میرود.
تقطیر در خلأ
برای جداسازی مخلوط مایعات با نقاط جوش بالا این فرایند بسیار مناسب است. حرارت دادن با دمای بالا یک روش ناکارآمد برای جوشاندن این ترکیبات است. در همین راستا فشار محیط بهجای آن کاهش پیدا میکند. کاهش فشار موجب میشود که ماده در دمای پایین جوش بیاید. زمانی که فشار بخار ماده با فشار بخار اطراف برابر باشد به بخار تبدیل میشود. سپس بخارات متراکم و مایع تبدیل میشوند. این روش برای بهدستآوردن نمونههایی با خلوص بالا از ترکیباتی که در دماهای بالا تجزیه میشوند مورداستفاده قرار میگیرد.
تقطیر خلأ حساس به هوا
ترکیباتی که حساس به هوا هستند و با آن بهراحتی واکنش میدهند، این روش در خلأ انجام میشود؛ ولی بعد از پایان فرایند، خلأ باید با گاز بیاثر جایگزین شود.
تقطیر مسیر کوتاه
این روش برای تصفیه مقادیر کم از ترکیبات که در دمای بالا ناپایدار هستند به کار میرود. این روش تحت سطح فشار کمتری صورت میگیرد و به طور کلی قبل از جمعآوری مقطر مسافت بسیار کمی را طی میکند. کاهش مسافت طی شده در دستگاه موجب کاهش اتلاف ماده در امتداد دیوارههای دستگاه میشود.
تقطیر منطقهای
این روش شامل ذوبشدن جزئی ماده و متراکم شدن بخارهای حاصل ازآنجهت رسیدن به یک مایع خالص است. این فرایند در ظرف بلند با کمک بخاری منطقهای انجام میشود و امکان دارد بارها جهت رسیدن به ماده موردنظر تکرار شود.
تقطیر واکنشی
طی آن رآکتور بهعنوان تبخیرکننده به کار میرود و دمای جوش محصول واکنش از دمای جوش واکنشدهندهها بسیار پایینتر است. طی آن ماده موردنظر موقعی شروع به تبخیر میکند که سایر واکنشدهندهها هنوز در فاز مایع قرار دارند و بخار حاصله جداسازی میشود.
تقطیر تخریبی
این روش با گرما دادن شدید مواد جامد در غیاب اکسیژن انجام میشود و مواد با نقطهجوش بالا بهصورت گاز متصاعد و جداسازی میشوند. با استفاده از این روش میتوان متانول را از چوب تهیه کرد.
 کاربرد فرایند تقطیر
کاربرد فرایند تقطیر
کاربردهای این فرایند به چهار دسته مقیاس صنعتی، آزمایشگاهی، صنایع غذایی، داروها و عطرسازی تقسیم میشود. دودسته آخر با دودسته اول از این نظر تفاوت دارند که در این گروه تقطیر برای خالصسازی انجام نمیشود، بلکه باهدف دستیابی به محصول مقطر نهایی انجام میشود. تفاوت اصلی مقیاس آزمایشگاهی و صنعتی در این است که در آزمایشگاهی تقطیر بهصورت ناپیوسته انجام میشود؛ ولی در صنعتی بهصورت پیوسته است.
در روش ناپیوسته ترکیب ماده اصلی، بخارات حاصل و مقطر بهدستآمده در طول عملیات و به نسبت زمان متغیر است. در این روش ابتدا مقداری ماده شیمیایی وارد دستگاه شده و تقطیر شروع میشود. سپس هر کدام از مواد به نسبت فراریت از محلول جدا میشوند. مادهای که فراریت بالایی دارد در مراحل اولیه و ماده دارای فراریت پایین در مراحل پایانی جدا میشود. بعد از اینکه عملیات بهصورت کامل انجام شد دوباره محلول جدید وارد میشود.
بهعنوانمثال گلابگیری با این روش انجام میشود که طی آن محلولی شامل آبوگل معطر وارد یک دیگ میگردد. ماده شیمیایی که بوی خوش را تشکیل میدهد به دلیل فراریت بیشتر سهم بیشتری از بخار را در شروع فرایند دارد. بر همین اساس بخار میعان شده در ابتدای فرایند درصد خلوص بالاتری از خود نشان میدهد. این فرایند برای خالصسازی الکل نیز مناسب است، الکل نسبت به آب فرارتر است.
همواره در فرایند پیوسته سعی میشود که ترکیب ماده اصلی، بخارات حاصل و برشهای تقطیر ثابت بماند. بهصورت مداوم محلول خوراک وارد برج تقطیر شده و محصولات خارج میگردند.
تقطیر آزئوتروپی چیست
فعلوانفعالات در بین اجزای محلول خصوصیاتی منحصربهفرد در محلول ایجاد میکند، چون بیشتر فرایندها مستلزم ایجاد مخلوط غیر ایدئال هستند. این فعلوانفعالات میتواند باعث یک آزئوتروپ در حال جوش ثابت شوند که همانند ماده خالص رفتار میکند. بهعنوانمثال آب و الکل اتیل یک آزئوتروپ 95.6٪ در دمای 78.1 درجه سانتیگراد به وجود میآورند. چنانچه آزئوتروپ برای استفاده بهاندازه کافی خالص نباشد، برخی تکنیکها برای تجزیه آزئوتروپ جهت ارائه یک ماده خالص وجود دارد. این مجموعه از تکنیکها را تقطیر آوتروپیک مینامند.
مایعات غیرقابلاختلاط از قبیل تولوئن و آب بهراحتی آزئوتروپ تشکیل میدهند. اغلب این آزئوتروپها را آزوتروپ کمجوش میگویند، زیرا نقطهجوش آزئوتروپ کمتر از نقطهجوش هر یک از اجزای خالص است. آزئوتروپ از طریق جداکننده مایع و مایع بهآسانی با تقطیر شکسته میشود تا دولایه مایع که بالای ستون متراکم شدهاند را جدا نماید.
تقطیر آب چگونه انجام میشود
این فرایند یکی از روشهای تصفیه آب است که با استفاده از یک منبع حرارتی آب را بخار کرده و آن را از آلودگیهای داخلش جدا میکند. عناصر نامطلوب همان مواردی هستند که بهصورت طبیعی در آبهای سطحی و زیرزمینی مشاهده میکنید. طی این روش آب تصفیه نشده تا زمانی که به نقطهجوش برسد گرم میشود و شروع به بخارشدن میکند. پس از آن گرمای آب در این دما نگه داشته شده تا بخار آب حفظ شود و از بخارشدن عناصر دیگر نیز جلوگیری میشود. همچنین این روش به جداسازی مولکولهای آب از هر ارگانیسم ایجادکننده بیماری میکروسکوپی نیز کمک مینماید. زمانی که آب بخار شود به یک کندانسور هدایت میشود تا خنک شده و مجدد به مایع تبدیل شود.
 تقطیر ایدهآل را بشناسید
تقطیر ایدهآل را بشناسید
اینکه فکر کنیم هر جز از محلول در دمای جوش مخصوص به خود میجوشد ما را دچار اشتباه میکند. زیرا در یک محلول در هر دمایی تمام اجزا تبخیر میشوند؛ ولی در دماهای پایینتر جزئی که فراریت بیشتری دارد سهم بیشتری از تبخیر به خود اختصاص میدهد؛ بنابراین با این فرایند امکان جداسازی خالص هر کدام از اجزا وجود ندارد. مدل تقطیر ایدئال از قانون دالتون و قانون رائولت پیروی میکند.
قانون رائولت بیان میکند که درصد حضور یک جز در بخار حاصل از یک محلول برابر است با ترکیب درصد آن در فاز مایع ضرب در فشار بخار آن موقعی که ماده خالص میباشد. به سهمی از فشار کل در بالای سطح مایع که توسط مولکولهای بخار مایع تأمین میشود فشار بخار مایع میگویند. برای مایعی معین، هر چقدر دما بالاتر رود فشار بخار مایع بیشتر میشود. اگر فشار بخار جزئی از محلول تحتتأثیر جز دیگر تغییر کند یا فراریت آن وابسته به درصد حضور آن در محلول باشد این قانون دیگر صدق نمیکند.
قانون دالتون میگوید کل فشار بخار محلول با جمع فشار بخار تکتک اعضا در دمای مشخص یکسان میباشد. زمانی که یک سیستم چندجزئی را گرم میکنیم فشار بخار هر جز آن بالا میرود و منجر به افزایش فشار بخار کل محلول میشود. وقتی فشار بخار به فشار محیط برسد محلول به جوش میآید و مولکولها شروع به کندن از فاز مایع و پیوستن به فاز بخار مینمایند. توجه داشته باشید که در این روش حالت جز فرارتر سهم بیشتری از فاز بخار را از خود عبور داده و درصد آن در فاز مایع با سرعت بیشتری کم میشود.
اغلب چنین مدلی برای مواد مشابه از نظر شیمیایی مانند تولوئن و بنزن صدق میکند. در موارد دیگر میزانی از انحراف از قانون دالتون و رائولت دیده میشود. مثال معروف این دسته مواد ترکیب آب و اتانول است.